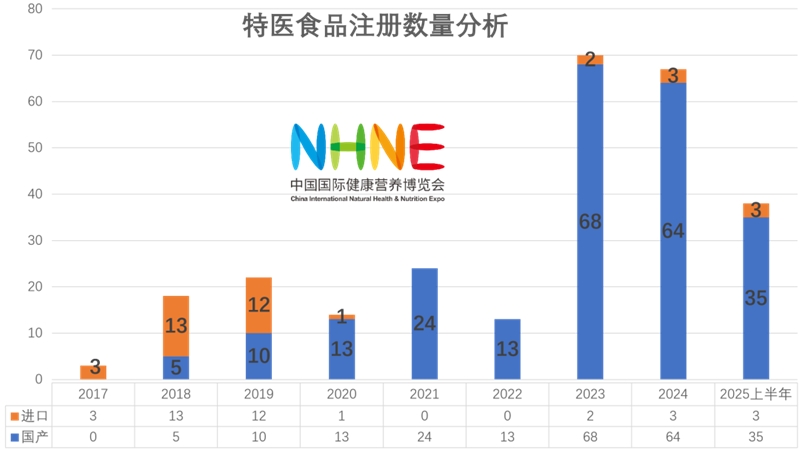
據國家市場監督管理總局特殊食品信息查詢平臺數據顯示,截至2025年6月30日,新增特醫食品獲批38款(其中進口產品3款,國產35款),已獲批特醫食品數量增至269款(含已注銷的5款)。NHNE將對所有獲批的特醫產品進行了統計匯總,并從多角度進行分析,供行業同仁了解和參考。
01
產品類型分析
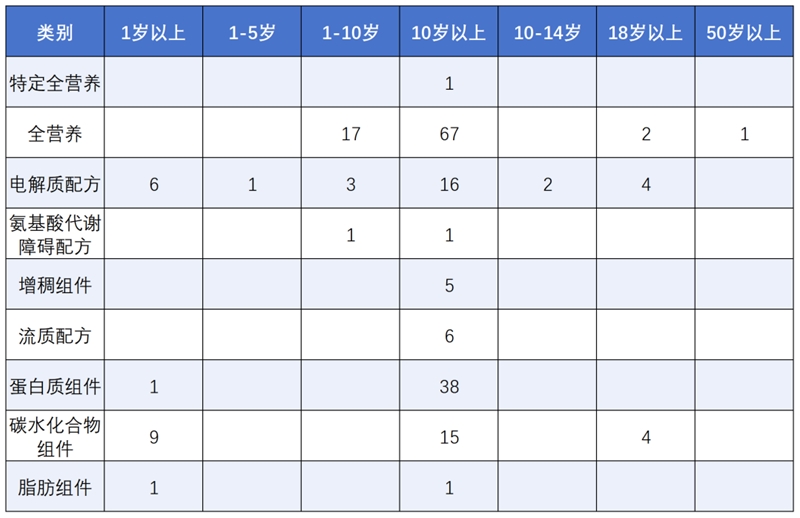
2025年上半年獲批的38款新產品中,青島圣桐生產的特愛本佳和特愛丙佳這兩款配方分別適用于苯丙酮尿癥、甲基丙二酸血癥和丙酸血癥等罕見病患兒食用,打破了國內無罕見病配方的局面,對我國特醫在罕見病領域的發展具有重要意義。獲批產品中全營養配方食品數量最多,為14款,占獲批總數的37%。其次為蛋白質(氨基酸)組件,為8款,占比21%,沒有特定全營養類產品獲批。從適用人群來看,2025年上半年獲批數量最多的為適用于10歲以上人群的產品,共21款,占比55%。還首次推出了兩款6~12月齡以及一款1~5歲適用的產品,針對人群年齡的劃分更加精細。
截至2025年6月30日,國家市場監督管理總局發布通過注冊的特醫食品有269款(含已注銷的5款),其中特醫嬰配食品67款,1歲以上特醫食品202款,具體產品情況如下圖所示:
特殊醫學用途配方食品
(適用于1歲以上人群)
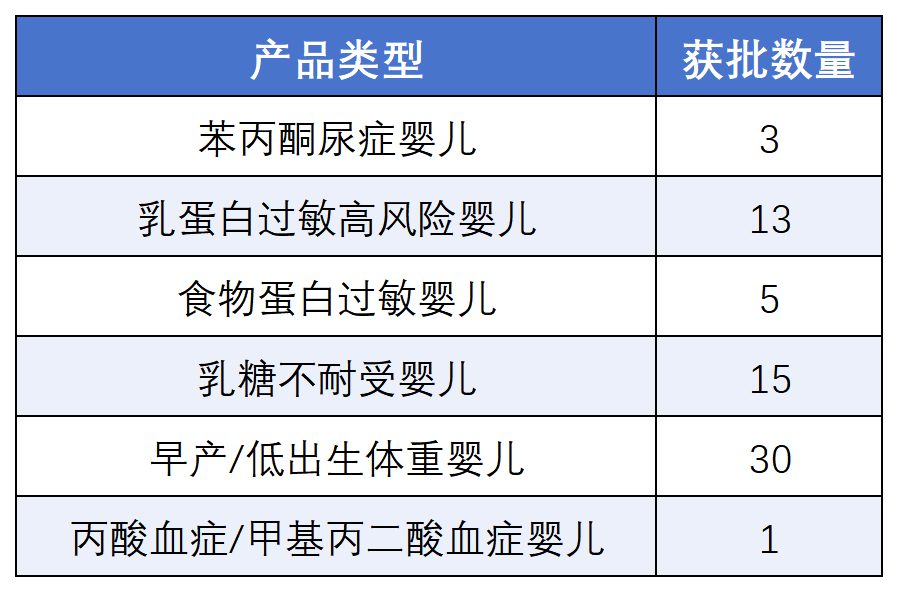
特殊醫學用途嬰兒配方食品
(適用于0月齡至12月齡兒童)
02
生產企業分析
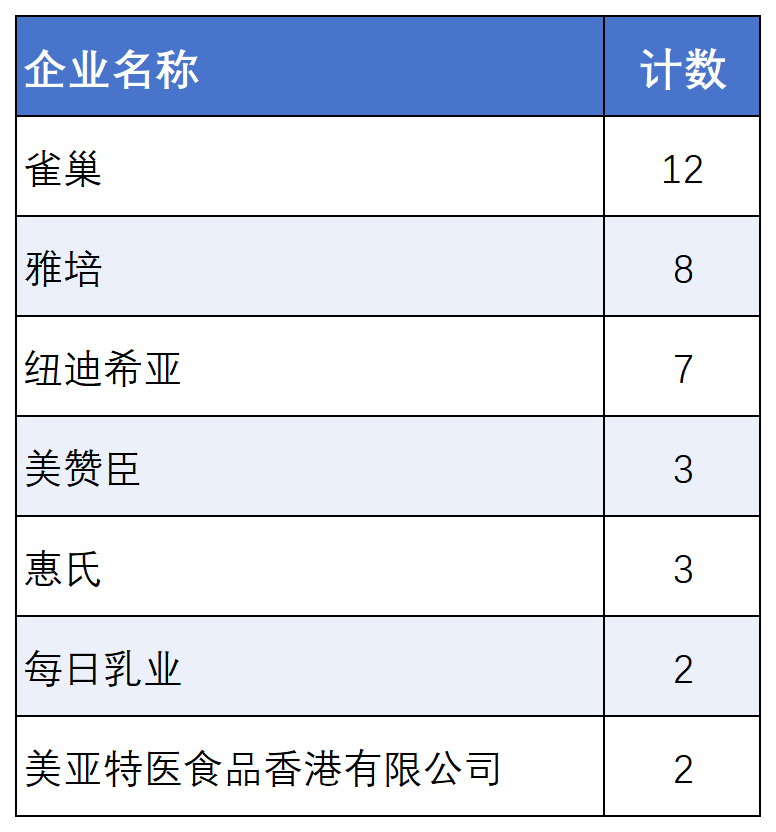
2025年上半年新增獲批企業13家,和氏乳業、美亞特醫(中國香港)、湯臣倍健、鑫禾健各,白云山漢方、廣西紅山堂、廣州力衡、華森制藥、山東隆慶祥、時代特醫、天源特醫、中恩醫藥和中特食品,截至目前,共有78家企業獲得特醫食品注冊,境內企業達到72家,境外企業6家(其中惠氏被雀巢收購,美樂寶被紐迪希亞收購)
國產企業獲批情況
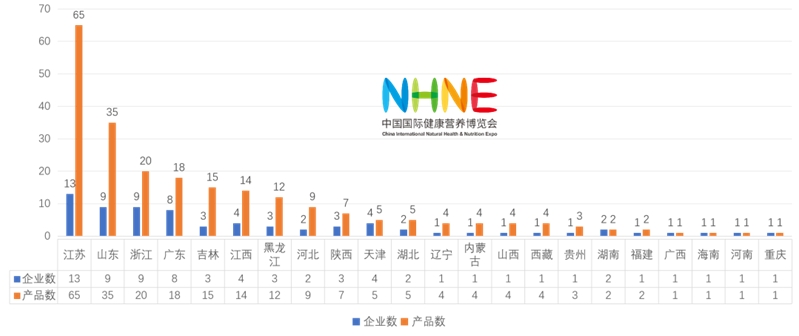
已獲批國產232款特醫食品中,所涉企業72家,分布在22個省市。獲批情況分析如下:
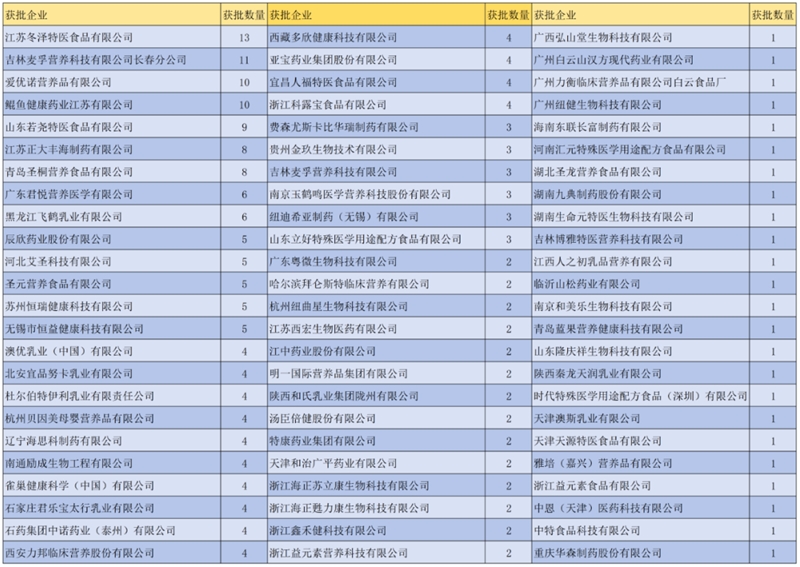
國產企業地域分布
進口企業獲批情況
2025年上半年,美亞特醫獲批2款香港首批特醫產品
03
產品劑型分析
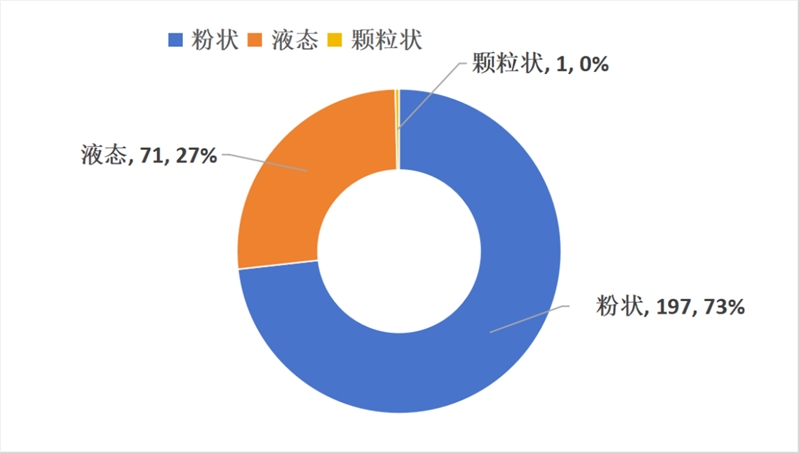
已獲批的特醫食品中粉劑197款,液態71款,顆粒狀1款。無新增其他劑型,分布情況如下圖:
04
總結分析
2025年上半年,我國特醫食品行業迎來密集政策紅利,國家多部門圍繞臨床試驗標準、注冊審評、應用場景拓展等關鍵環節推出一系列新規,旨在加速產業創新與規范化發展。從統計分析中可以看出,2025年上半年特醫食品的獲批數量延續了2024年的高增長趨勢。
一、臨床試驗標準優化與擴容
1、新增兩項臨床試驗指導原則
2025年5月26日,市場監管總局發布《特定全營養配方食品臨床試驗技術指導原則 肝病》和《胃腸道吸收障礙》,填補了這兩類疾病特醫食品臨床試驗的技術空白。文件統一了九大章節框架(如試驗設計、觀察指標等),取消樣本量硬性要求,試驗周期更具靈活性。
2、三項國標征求意見稿發布
2025年4月2日,糖尿病、腎病、腫瘤三類特定全營養配方食品的臨床試驗國家標準啟動征求意見。相較于2019年版,新版刪除“試驗組有效例數不少于100例”的硬性要求,調整為“符合統計學要求”,并收緊試驗方法(如糖尿病和腫瘤類僅接受隨機對照試驗)。
二、注冊審評制度改革
1、分類注冊指南完善
全營養配方:2025年初發布注冊指南,簡化材料提交(如免交配方設計依據、生產工藝設計依據等原始文件),明確僅三種情形需現場核查(如首次申請注冊、生產線首次使用等)。
氨基酸代謝障礙類:同步發布注冊指南,允許生產工藝相似產品豁免現場核查,降低罕見病特醫食品研發門檻。
2、優先審評通道深化
臨床急需產品(如罕見病類)審批時限縮短至30個工作日,加速填補供給缺口。
三、標準體系與標簽標識規范
1、特醫嬰配新國標發布(GB 25596-2025)
2025年3月27日發布,新增生酮配方、防反流配方、脂肪代謝異常配方等6類產品,調整能量計算方式(如膳食纖維能量系數明確為8kJ/g),并將膽堿調整為必需成分。新標準于2027年3月實施,配套發布注冊銜接問答。
2、標簽標識統一要求
《食品標識監督管理辦法》(2025年3月發布)要求特醫食品集中標注六項核心信息(如適用人群、營養成分等),防止消費誤導,2027年3月實施。
四、產業協同與支付創新
1、納入國家健康消費戰略
商務部等12部門《促進健康消費專項行動方案》將特醫食品列為重點領域,鼓勵企業加強創新,探索“醫保+商保”支付模式(如南通試點商業保險報銷)。
2、多部門聯動機制強化
市場監管總局與國家衛健委建立“技術聯動、專家聯審”機制,對臨床急需產品優先審評;推動特醫食品納入醫療機構HIS系統,破解“進院難”問題。
五、地方試點與場景拓展
1、江蘇創新舉措打通特醫食品經營環節瓶頸堵點
2025年1月發布省級指導意見,選取三甲醫院開展規范化試點(如納入HIS系統),并在養老機構配備營養師推廣個性化方案。無錫將特醫食品暫納入醫保個人賬戶支付范圍。
2、四川規范醫療機構管理
2025年1月出臺《醫療機構特醫食品經營使用管理辦法》,要求醫院成立特醫食品管理委員會,明確處方開具、不良反應上報等流程,首次實現經營與臨床應用的統一監管。
3、海南省發布先行區特醫食品申報指南,明確申報要求,為特醫食品在海南自由貿易港的臨時進口提供了明確的操作路徑和規范
05
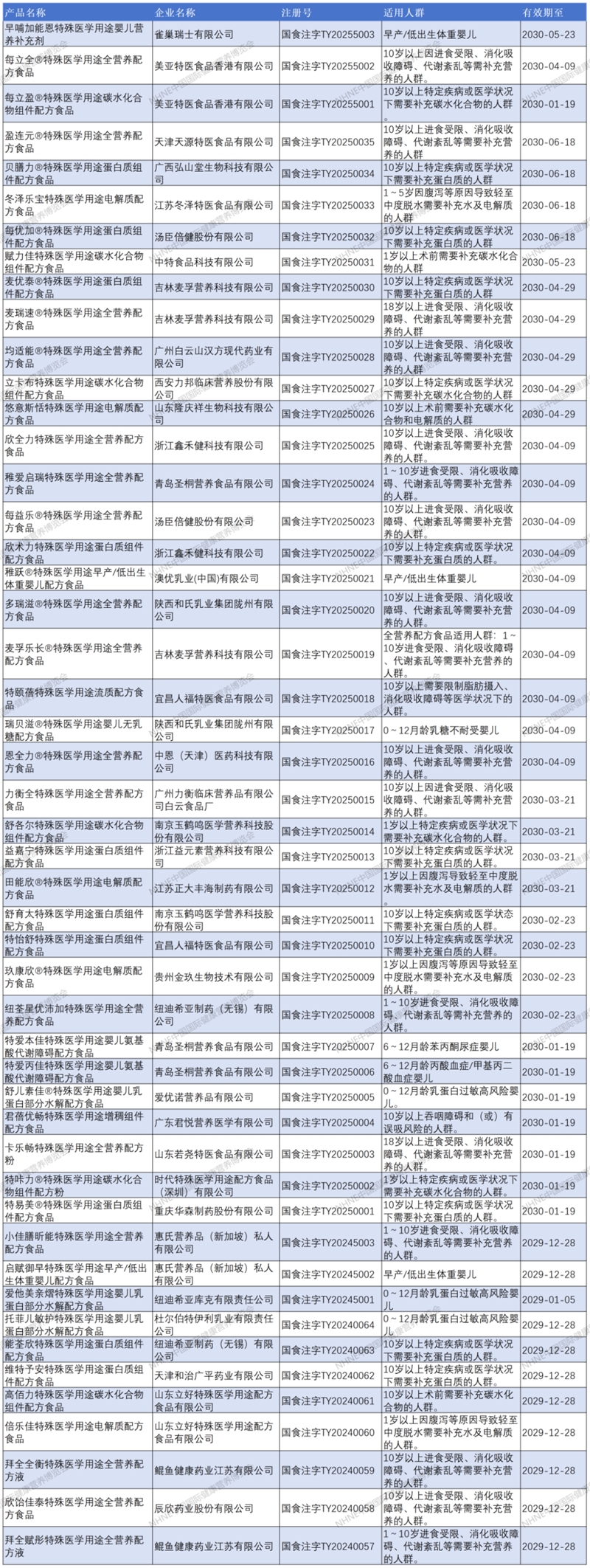
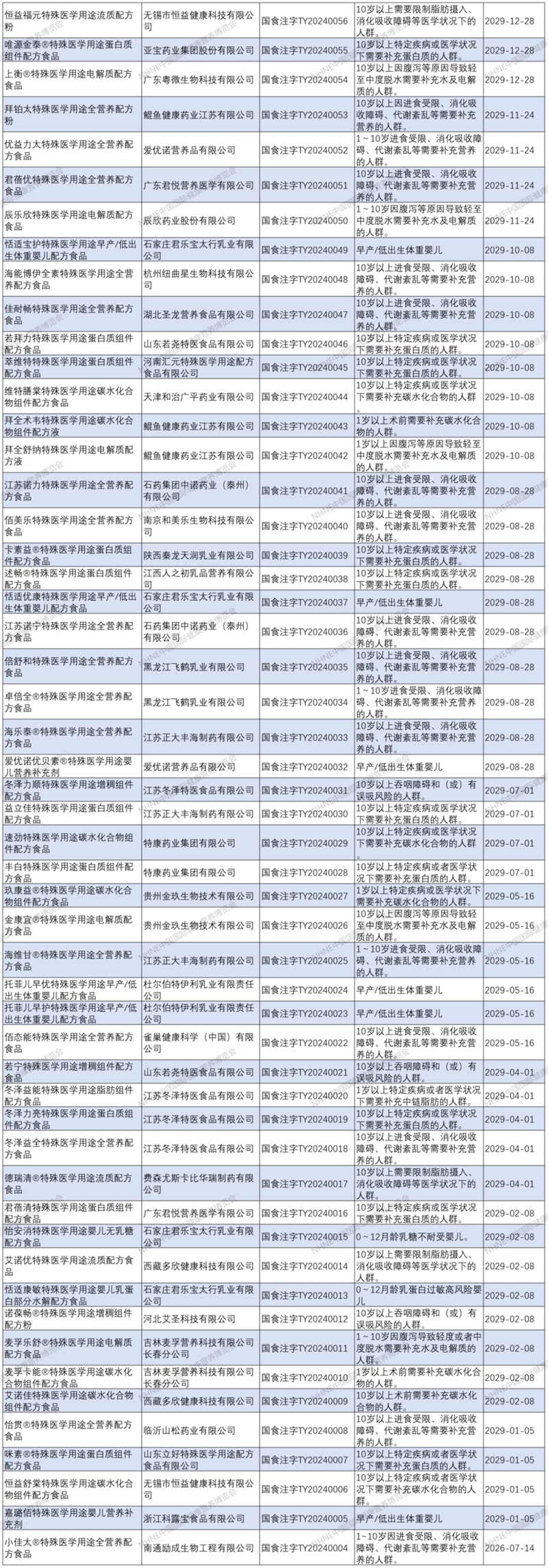
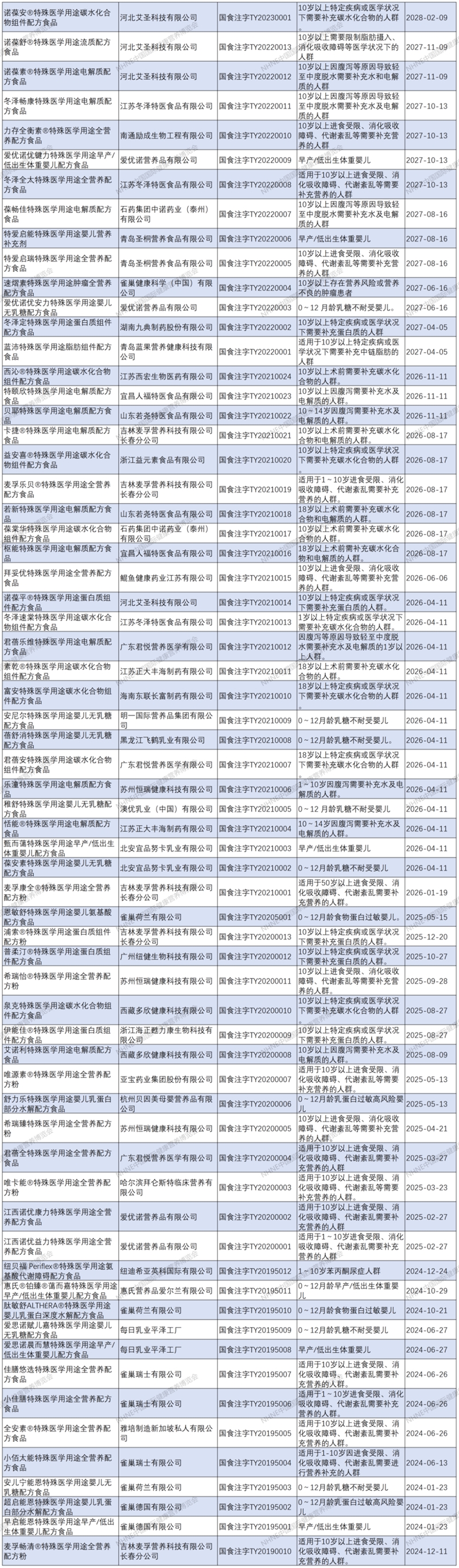
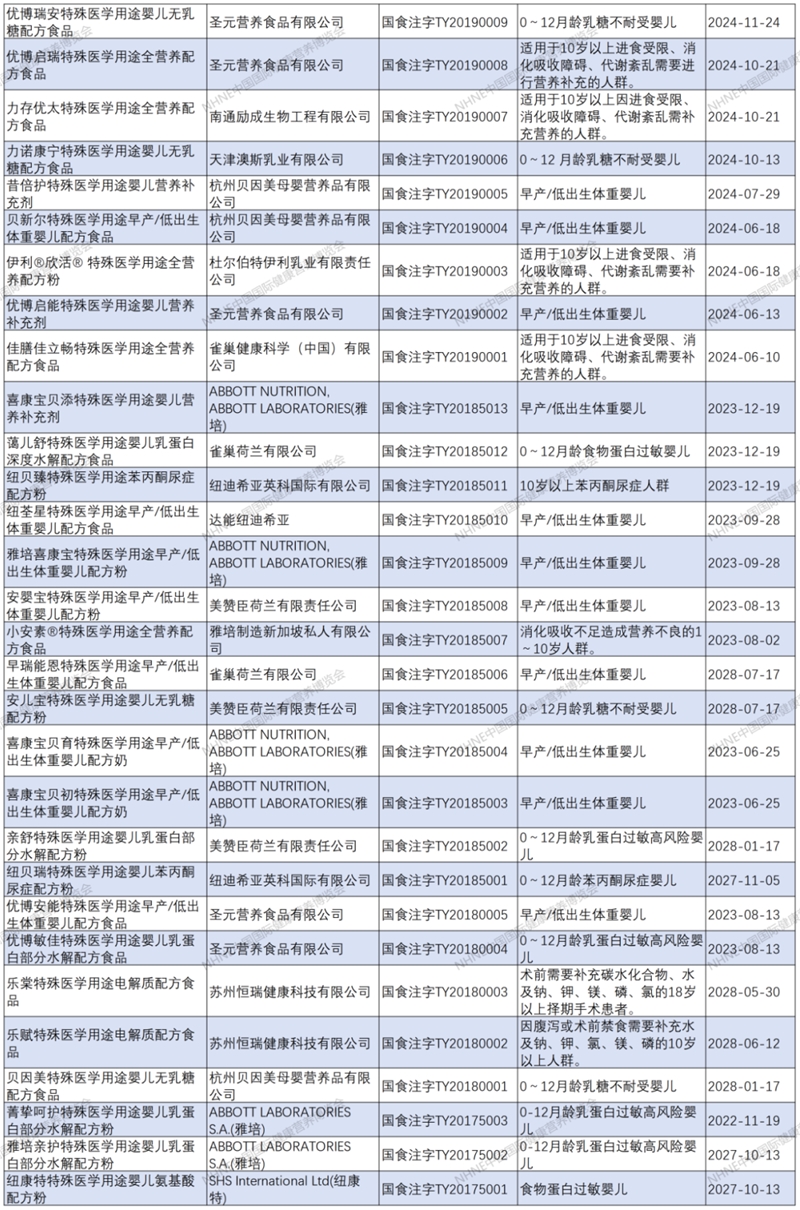
特醫食品注冊清單

在線咨詢